Параллельные реакции
Очень часто, особенно в органической химии, исходные вещества реагируют сразу по нескольким направлениям, причем в каждом – со своей скоростью. Например, при нитровании фенола получаются три изомера: орто-, мета-, и пара-. Или при разложении бертолетовой соли:
![]()
Рассмотрим простейший случай двух параллельных необратимых реакций первого порядка:
![]() , где:
, где:
а – начальная концентрация вещества А,
х – количество вещества А, вступившего в реакцию к моменту времени τ,
х1 – количество вещества А, вступившего в реакцию по направлению 1,
х2 – количество вещества А, вступившего в реакцию по направлению 2.
х= х1+ х2 (1)
![]() ;
; ![]() (2);
(2);
![]() (3)
(3)
![]() (4);
(4);
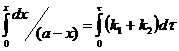
![]() (5)
(5)
Уравнение (5) похоже на уравнение, полученное для необратимой реакции 1-го порядка.
Экспериментально определяя х для какого-то τ по уравнению (5), вычисляем сумму констант скоростей ![]() . Для вычисления каждой константы в отдельности необходимы дополнительные условия:
. Для вычисления каждой константы в отдельности необходимы дополнительные условия:
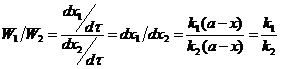
![]() ;
;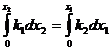 ;
;![]() ;
;![]() (6)
(6)
Отношение количеств исходного вещества, вступивших в реакцию в том и другом направлении, в течение всего процесса постоянно.
Используя уравнения (6) и (5), можно вычислить каждую из констант в отдельности. Рассмотрим случай двух параллельных необратимых реакций 2-го порядка.
![]() , где: а и b – концентрации исходных веществ,
, где: а и b – концентрации исходных веществ,
х – убыль концентрации одного из реагирующих веществ.
![]()
![]() ,
,
Аналогично полученному ранее для необратимой реакции 2-го порядка.
Смотрите также
Крашение натурального шелка бромакриламидными красителями
...
Витамины В12 и В15
Витамины (от лат. Vita – жизнь) - группа органических соединений
разнообразной химической природы, необходимых для питания человека, животных и
других организмов в ничтожных количествах по с ...
Каучуки
Каучуки — натуральные или
синтетические материалы, характеризующиеся эластичностью, водонепроницаемостью
и электроизоляционными свойствами, из которых путём специальной обработки
получают р ...
