Дигалогениды.
Дихлорид
SnCl
2
– бесцветное кристаллическое вещество; легко растворяется в воде, спирте, эфире, ацетоне. Из водных растворов кристаллизуется в виде SnCl2 • 2Н2О («
оловянная
соль»).
В водном растворе SnCl2 подвергается гидролизу, который протекает в существенно меньшей степени, чем в случае SnCl4, так как основные свойства у олова(П)
выражены сильнее, чем у олова(IV):
SnCl2 + H2O = Sn(OH)Cl + HCl.
В растворе содержатся не только SnOH+, но и более сложные полимерные ионы, например [Sn3(OH)4]2+ и [Sn(OH)2Cl2]2-, которые могут взаимодействовать между собой.
Твердый SnCl2 также имеет полимерное строение. Его слоистая структура составлена из тригонально-пирамидальных групп [SnCl3], связанных друг с другом через атомы хлора:
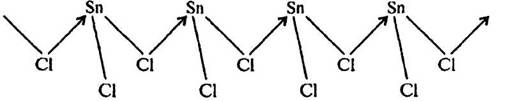
Рис. 2. Строение SnCl2.
В парах SnCl2 представляет собой угловую молекулу: угол ClSnCI составляет 95o. Несвязывающая электронная пара олова направлена к вершине треугольника. Характер связи (наложение ковалентной и ионной составляющих) Sn–Cl в SnCl2 и SnCl4 одинаков, но из-за цепочечного характера связей в твердом состоянии SnCl2 менее устойчив и легко диспропорционирует:
2SnCl2 = SnCl4 + Sn.
Дихлорид SnCl2 — сильный восстановитель. Он восстанавливает из растворов солей до металлов золото, серебро, ртуть, висмут, Fe3+ до Fe2+, хроматы до Сг3+ , перманганаты до Мn2+ , нитрогруппу до аминогруппы, бром до бромид-иона, сульфит-ион до серы, например:
2SnCl2 + H2SO3 + (2x + l)H2O = 2SnO2*xH2O + S + 4HCI
или
2SnCl2 + H2SO3 + 8НС1 = S + 2H2[SnCl6] + 3H2O,
SnCl2 + Br2 + (2 + x)H2O = 2HC1 + 2HBr + SnO2 • xH2O
или
3SnCl2 + 3Br2 + (2 + x)H2O = H2[SnCI6] + H2[SnBr6] + SnO2 • xН2О.
В водном растворе SnCI2 медленно окисляется кислородом воздуха. Чтобы препятствовать этому, в раствор добавляют металлическое олово. Остальные дигалогениды олова весьма сходны по свойствам с SnCl2.
Дигалогениды олова синтезируют нагреванием олова в токе галогеноводорода или осторожным обезвоживанием кристаллогидратов SnX2 • nН2О, полученных растворением олова в соответствующих галогеноводородных кислотах. Безводные SnX2 можно получить также непосредственным взаимодействием галогенов с избытком олова.
Все дигалогениды олова образуют комплексы (ЩЭ)[SnХз] и (ЩЭ)2lSnX4], но они менее устойчивы, чем производные олова(IV). Получают их в растворах соответствующих галогеноводородных кислот или их солей по реакции
SnX2 + 2NaX = Na2[SnX4].
В концентрированных растворах равновесие смешено вправо, при разбавлении смещается влево. Устойчивость галогенидных комплексов изменяется в следующем ряду: F > CI > Вг > I.
Многие галогениды олова, такие как SnCI4, SnCI2, а также продукты их гидролиза, например, Na2[Sn(OH)6], используют в качестве протрав при крашении тканей. Тетрахлорид SnCl4 применяют для приготовления дымовых завес и в качестве катализатора при хлорировании, а в органической химии — как стимулятор процесса конденсации. [3]
Таблица 2. Свойства дигалогенидов олова
|
SnX2 |
Tпл, оC |
Ткип, оС |
Цвет |
Отношение к воде |
∆fHо298 кДж/моль |
|
SnF2 |
210 |
— |
Бесцветный |
Растворим |
-648 |
|
SnCl2 |
247 |
623 |
Бесцветный |
Растворим |
-352 |
|
SnBr2 |
232 |
620 |
Бледно-желтый |
Растворим |
-254 |
|
Snl2 |
320 |
720 |
Оранжево-красный |
Нерастворим |
-152 |
Смотрите также
Химические способы очистки поверхностей полупроводниковых пластин
Современный этап развития радиоэлектроники
характеризуется широким применением интегральных микросхем (ИМС) во всех
радиотехнических системах и аппаратуре. Это связано со значительным усложн ...
Выводы
Можно
сделать несколько выводов из рассмотрения проблемы
1.
Проблемы
экологии. В частности, пр ...
Элементарные стадии с участием координационных и металлоорганических соединений в растворах и на поверхности металлов и оксидов
Элементарные стадии органических реакций,
катализируемых кислотами, основаниями, нуклеофильными катализаторами,
комплексами металлов, твердыми металлами и их соединениями в газофазных или
ж ...
