Галогениды олова. Тетрагалогениды.
Известны все четыре тетрагалогенида олова
(табл. 1). Молекулы SnX4 представляют собой правильные тетраэдры с атомом Sn в центре. Все тетрагалогениды олова, кроме SnF4, не содержат мостиковых атомов галогена, благодаря чему эти соединения легкоплавки и легколетучи. В тетрафториде
SnF
4
имеются октаэдрические фрагменты SnF6, образующие слои за счет мостиковой функции четырех (экваториальных) атомов фтора (олово(IV) имеет КЧ = 6). Естественно, что мостиковый характер SnF4 и больший ионный вклад в связь Sn—F по сравнению со связью Sn—X в других тетрагалогенидах приводит к существенно большей прочности кристаллической структуры SnF4 (температура возгонки 705 °С). [1]
Фторид
SnF4 — бесцветное кристаллическое вещество, растворяется в воде с большим выделением тепла. С водными растворами фторидов образуются фторостаннаты (ЩЭ)2[SnF6].
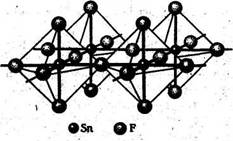
Рис. 1. Структура SnF4
Тетрахлорид
SnCI
4
— бесцветная, дымящая на воздухе подвижная жидкость, растворяется в неполярных органических растворителях, с бензолом и сероуглеродом смешивается в любых отношениях. Тетрахлорид олова растворяет серу, фосфор, иод, тетраиодид олова. При растворении в воде SnCI4 подвергается гидролизу с образованием SnO2 • xH2O и гексахлорооловянной кислоты H2[SnCl6]:
3SnCl4 + 2H2O = SnO2 + 2H2[SnCl6].
Последнюю можно выделить из раствора в виде кристаллогидрата состава H2[SnCl6] • 6Н2О. Гексахлорооловянная кислота является сильной кислотой; растворы ее солей, благодаря отсутствию гидролиза, имеют нейтральную реакцию и не разрушаются даже при кипячении.
Из водного солянокислого раствора тетрахлорида олова можно выделить кристаллогидрат
SnCl
4
• 5Н2О
в виде белых легко расплывающихся кристаллов. Кристаллогидрат SnCl4 • 5Н2О, по-видимому, следует рассматривать как комплексное соединение H
2
[
SnCl
4
(
OH
)2]
• ЗН2О,
устойчивое в присутствии НС1, которая подавляет гидролиз SnCl4. Известны также соли состава (ЩЭ)[SnCI5] с тригонально-бипирамидальным анионом.
Тетрабромид
SnBr
4
— бесцветное кристаллическое вещество, растворимое в ацетоне и трихлориде фосфора РС13, в водном растворе гидролизуется, но из кислых растворов удалось выделить кристаллогидрат SnBr4*4H2O. Получены также гексабромооловянная кислота H2[SnBr6] и ее соли.
Тетраиодид
SnI
4
— желтое кристаллическое вещество, легко растворяется в спирте, эфире, бензоле, сероуглероде; в водном растворе гидролизуется; иодостаннаты состава (ЩЭ)2[SnI6] получены только для рубидия и цезия.
Все SnX4, кроме SnF4, получают
взаимодействием олова с избытком галогена:
Sn + 2Х2 = SnX4.
Тетрафторид синтезируют действием безводного фтороводорода на SnCl4.
Известны также смешанные тетрагалогениды олова,
например, SnClBr3, SnCl3Br, SnBr2I2, которые по свойствам сходны с «однородными» галогенидами.
Таблица 1.Свойства тетрагалогенидов олова
|
SnX4 |
Tпл, оC |
Ткип, оС |
Цвет |
Энергия связи Sn – X, кДж/моль |
∆fHо298 кДж/моль |
|
SnF4 |
- |
705(возг) |
Бесцветный |
414 |
- |
|
SnCl4 |
-36 |
114 |
Бесцветный |
323 |
-529 |
|
SnBr4 |
33 |
203 |
Бесцветный |
273 |
-406 |
|
SnI4 |
146 |
346 |
Жёлтый |
205 |
-215 |
Смотрите также
Способы получения синтез-газа из угля
Газификация —
высокотемпературный процесс взаимодействия углерода топлива с окислителями,
проводимый с целью получения горючих газов (Н2, СО, СН4).
Первым способом получения синтез-газа был ...
Синтез хлороформа. Реакции нуклеофильного замещения и элиминирования галогеналканов
...
Источники возбуждения спектров
В практике
атомно-эмиссионного спектрального анализа в качестве источников возбуждения
спектров применяют пламя, электрические дуги постоянного и переменного тока,
низко- и высоковольтную конденсир ...
