Неорганические соединения
Окись серебра, Ag2O, получают при обработке растворов AgNO3 щелочами или растворами гидроокисей щелочноземельных металлов:
2AgNO3 + 2КОН = Ag2O + 2KNO3 + Н2O
Окись серебра представляет собой диамагнитный кристаллический порошок (кубические кристаллы) коричнево-черного цвета с плотностью 7,1 — 7,4 г/см3, который медленно чернеет на свету высвобождая кислород, и разлагается на элементы при нагреваний до +200°C:
Ag2O=2Ag + ½O2
Водород, окись углерода, перекись водорода и многие металлы восстанавливают окись серебра в водной суспензии до металлического серебра:
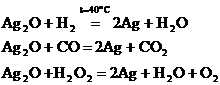
При окислении Ag2O озоном образуется окись серебра(II) Окись серебра (I) растворяется в плавиковой и азотной кислотах в солях аммония, в растворах цианидов щелочных металлов, в аммиаке и т. д.
Ag2O + 2HF = 2AgF + Н2O
Ag2O + 2HNO3 = 2AgNO3
Ag2O + 2(NH4)2CO3 = [Ag(NH3)2]2CO3 + 2H2O +CO2
Ag2O + 4KCN + H2O = K[Ag(CN)2] + 2KOH
Ag2O + 4NH4OH = 2[Ag(NH3)2]OH + 3H2O или
Ag2O + 4NH3 + H2O = 2[Ag(NH3)2]OH
При хранении гидроокись диамминсеребра [Ag (NH3)2]OH (которая является растворимым основанием с окислительными cсвойствами) превращается в способный взрываться имид серебра;
2[Ag(NH3)2]OH = Ag2NH + 3NH3 + 2H2O
Растворы хлоридов щелочных металлов превращают окись серебра(I) в хлорид серебра(I), а при действии избытка HgI2 нa Ag2O образуется Ag2[HgI4].
Окись серебра — энергичный окислитель по отношению к соединениям хрома(III), альдегидам и галогенопроизводным углеводородов:
5Ag2O + Cr2О3= 2Ag2CrO4 + 6Ag
3Ag2O + 2Cr(OH)3 + 4NaOH = 2Na2GrO4 + 6Ag + 5H2O
Окисление галогенопроизводных углеводородов приводит к образованию спиртов, а окисление альдегидов — соответствующих кислот.
Растворы сульфидов щелочных металлов и водные суспензии сульфидов тяжелых металлов превращают окись Ag2O в сульфид Ag2S.
Суспензии окиси серебра применяются в медицине как антисептическое средство. Смесь, состоящая из окиси серебра с легко восстанавливающимися окислами (например, меди или марганца). является хорошим катализатором окисления окиси углерода кислородом воздуха при обычной температуре. Смесь состава 5% Ag3O, 15%Сo2Оз, 30% СuО и 50% МnO2, названная «гопкалитом», служит для зарядки противогазов в качестве защитного слоя против окиси углерода.
Гидроокись серебра, AgOH, образуется в виде неустойчивого белого осадка в результате обработки AgN03 спиртовым раствором калиевой щелочи при рН = 8,5 9 и температуре -45°C.
Соединение AgOH обладает амфотерными свойствами, легко поглощает двуокись углерода из воздуха и при нагревании с Na2S образует аргентаты эмпирических формул Ag2O • 3Na2O и Ag2O • 3Na2O.
Основные свойства гидроокиси серебра усиливаются в присутствии аммиака вследствие образования гидроокиси диамминсеребра [Ag (NH3)2]OH.
Фторид серебра, AgF, получают прямым взаимодействием элементов при нагревании, действием плавиковой кислоты на окись или карбонат серебра(I), термическим разложением (+200°C) Ag[Bp] причем наряду с AgF образуется BF3:
2Ag + F2 = 2AgF + 97,4 ккал
Ag2CO3 + 2HF = 2AgF + H2O + CO2
Ag2O + 2HF = 2AgF + H2O
Ag[BF4] = AgF + BF3
Выделение кристаллов AgF из водного раствора осуществляется путем концентрирования в вакууме в темноте.
Смотрите также
Вторая группа периодической системы
Вторая группа отличается от других одинаковостью структуры
внешнего электронного слоя у атомов всех входящих в неё элементов. С другой
стороны, второй снаружи слой, оставаясь законченным ...
Аммиачная селитра
Важнейшим видом минеральных
удобрений являются азотные: аммиачная селитра, карбамид, сульфат аммония,
водные растворы аммиака и др. Азоту принадлежит исключительно важная роль в
жизнедеятел ...
Технологии для улучшения экологических и эксплуатационных
характеристик дизельных топлив
Экологически
чистое дизельное топливо выпускают
по ТУ 38.1011348—89. Технические условия предусматривают выпуск двух марок
летнего (ДЛЭЧ-В и ДЛЭЧ) и одной марки зимнего (ДЗЭЧ) дизельного топлива с
...
