Структура воды
Английский физик Генри Кавендиш обнаружил, что водород Н и кислород О образуют воду. В 1785 г. французскими химиками Лавуазье и Менье было установлено, что вода состоит из двух весовых частей водорода и шестнадцати весовых частей кислорода.
Однако нельзя думать, что это представление, выражающееся химической формулой Н2О, строго говоря, верно. Атомы водорода и кислорода, из которых состоит природная вода, или, точнее, окись водорода, могут иметь различный атомный вес и значительно отличаться друг от друга по своим физическим и химическим свойствам, хотя и занимают в периодической системе элементов одно и то же место.
Это так называемые изотопы. Известны пять различных водородов с атомными весами 1, 2, 3, 4, 5 и три различных кислорода с атомными весами 16, 17 и 18. В природном кислороде на 3150 атомов изотопа О16 приходится 5 атомов изотопа кислорода О17 и 1 атом изотопа кислорода О18. В природном газообразном водороде на 5,5 тыс. атомов легкого водорода Н (протия) приходится 1 атом Н2 (дейтерия). Что касается Н3 (трития), а также Н4 и Н5, то их в природной воде на Земле ничтожно мало, но участие их в космических процессах при низких температурах в межпланетном пространстве, в телах комет и т п. весьма вероятно.
Ядра атомов изотопов содержат одинаковое число протонов, но разное число нейтронов. Атомные массы изотопов различны.
Вокруг ядра атома водорода вращается один единственный электрон, поэтому атомный номер водорода равен единице. Этот электрон вращается по круговым орбитам, в совокупности образующим сферу. Орбит множество, и в зависимости от нахождения электрона на или иной круговой орбите у атома водорода может существовать множество энергетических состояний электрона, т. е. он может быть в спокойном или более или менее возбужденном состояниях.
У атома кислорода 8 электронов (атомный номер 8), 6 из которых движутся по наружным орбитам, представляющим форму восьмерки или гантели, и 2 по внутренней круговой орбите. В соответствии с количеством электронов в ядре атома кислорода 8 протонов, таким образом, сам атом в целом нейтрален.
Наиболее устойчивой наружной орбитой атома является состоящая из 8 электронов, а у кислорода их 6, т, е., не хватает 2 электронов. В то же время водород, как и кислород, существует в молекулах, содержащих 2 атома (Н2), связанных между собой двумя электронами, которые легко замещают вакансию двух электронов наружной орбиты атома кислорода, образуя в совокупности молекулу воды, с полной устойчивой восьмиэлектронной наружной 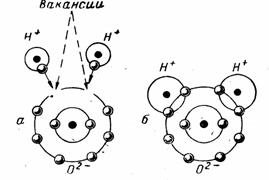 орбитой (см рис 1.).
орбитой (см рис 1.).
Рис 1. Схема образования молекулы воды (б) из 1 атома кислорода и 2 атомов водорода (а).
Можно привести много различных схем образования молекулы воды, основанных на представлениях разных физиков. По существу в них нет никаких противоречий и принципиальных различий. Ведь в действительности ни строения атомов, ни строения молекулы никто не видел, поэтому гипотетические схемы строятся лишь на основе косвенных наблюдаемых приборами признаков, позволяющих предположить как поведение, так и свойства атомов и молекул.
Размеры атомов различных элементов колеблются примерно от 0,6 до 2,6 А, а величины длины световой волны – в несколько тысяч раз больше: (4,5-7,7)*10-5 см. К тому же и атомы, и молекулы не имеют четких границ, чем и объясняется существующий разнобой вычисленных радиусов.
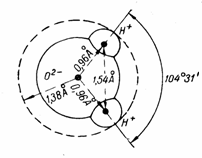 При нормальных условиях следовало бы ожидать, что связи атома кислорода с обоими водородными атомами в молекуле Н2О образуют у центрального атома кислорода очень тупой угол, близкий к 180°. Однако совершенно неожиданно этот угол равен не 180°, а всего лишь 104°31'. Вследствие этого внутримолекулярные силы компенсируются не полностью и их избыток проявляется вне молекулы. На рис. 2 показаны основные размеры молекулы воды.
При нормальных условиях следовало бы ожидать, что связи атома кислорода с обоими водородными атомами в молекуле Н2О образуют у центрального атома кислорода очень тупой угол, близкий к 180°. Однако совершенно неожиданно этот угол равен не 180°, а всего лишь 104°31'. Вследствие этого внутримолекулярные силы компенсируются не полностью и их избыток проявляется вне молекулы. На рис. 2 показаны основные размеры молекулы воды.
Рис 2. Молекула воды и ее размеры.
В молекуле воды положительные и отрицательные заряды распределены неравномерно, асимметрично. Такое расположение зарядов создает полярность молекулы. Хотя молекула воды нейтральна, но в силу своей полярности она ориентируется в пространстве с учетом тяготения своего отрицательно заряженного полюса к положительному заряду и положительно заряженного полюса к отрицательному заряду.
Внутри молекулы воды это разделение зарядов по сравнению с разделением зарядов у других веществ очень велико. Это явление называют дипольным моментом. Эти свойства молекул воды (называемые также диэлектрической проницаемостью, которая у Н2О очень велика) имеют очень большое значение, например в процессах растворения различных веществ.
Смотрите также
Химия в сельском хозяйстве и её направления
Химизация — это одно из направлений научно-технического прогресса,
основанное на широком применении химических веществ, процессов и методов в
различных отраслях, например в сельском хозяй ...
