Самостоятельная работа по физической химии
Вычислим изменение энтропии:
![]()
![]() Дж/К
Дж/К
Повышение температуры T=1273К
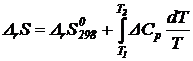
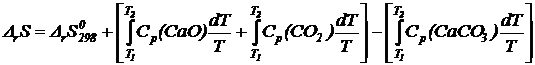
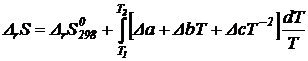
![]()
![]()
![]()
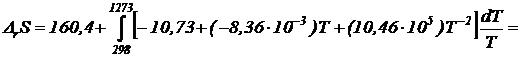
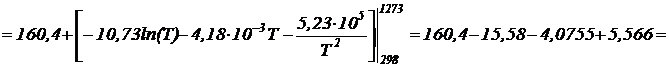
![]() Дж/К
Дж/К
Вывод: так как энтропия убывает, то процесс необратимый
Вычислим энергию Гиббса:
![]() Дж
Дж![]() кДж.
кДж.
Вывод: так как DrG<0, то процесс самопроизвольный, необратимый
Вычислим изменение внутренней энергии:
![]() ,
, ![]() ,
, ![]()
![]() Дж
Дж![]()
Вывод: внутренняя энергия возрастает
Вычислим изменение работы:
![]()
![]()
![]()
Вычислим энергию Гельмгольца:
![]()
![]() =
=![]() Дж
Дж![]() кДж
кДж
Вывод: процесс самопроизвольный в открытой системе
Вычислим константу химического равновесия:
![]() , R=8,314Дж/моль∙К, Т=1273К
, R=8,314Дж/моль∙К, Т=1273К
![]() =
=![]() =8,81804
=8,81804
Ответ: DrH0298=177,39 кДж, DrH=163,21 кДж, DrS=146,31 Дж/К, DrG=-23,04 кДж, DrU=152,63 кДж, DrA=-152,63 кДж, ∆rF=-33,63кДж, Kp=8,82.
Смотрите также
Элементарные стадии химических реакций (основы теории)
...
Карбоновые кислоты - свойства, получение и производные
...
Роль химии в решении сырьевой, энергетической и экологической проблемах
В наши дни, когда
человеческое развитие достигло высот, такие проблемы, как экология,
продовольствие, энергия заставляют задуматься о будующем.
Как мне кажется, эта
тема наиболее актуа ...
