Веса и символы
Поворотный этап в истории развития химической атомистики связан с именем шведского химика Иёнса Якоба Берцелиуса [43]. Он вслед за Дальтоном внес особенно большой вклад в создание атомистической теории. Примерно о 1807 г. Берцелиус вплотную занялся определением точного элементного состава различных соединений. Проведя не одну сотню анализов, он представил столько доказательств, подтверждавших закон постоянства состава, что химики были вынуждены признать справедливость этого закона, а следовательно, и принять атомистическую теорию, которая непосредственно вытекала из закона постоянства состава. https://info-farm.ru как сделать жидкое хозяйственное мыло.
Далее Берцелиус принялся за определение атомных весов более сложными и точными методами, которые были недоступны Дальтону. В этой своей работе Берцелиус использовал законы, открытые Дюлонгом и Пти, Митчерлихом и Гей-Люссаком (но, подобно большинству своих современников, не воспользовался гипотезой Авогадро).
В 1826 г. Берцелиус опубликовал первую таблицу атомных весов. Приведенные в ней величины в основном совпадают (за исключением атомных весов двух-трех элементов) с принятыми в настоящее время. Эта таблица, опубликованная в издававшихся самим И. Берцелиусом «Годичных обзорах», вошла в историю химии как таблица 1826 г.
Существенное различие между таблицами Берцелиуса и Дальтона состоит в том, что величины, полученные Берцелиусом, в большинстве не были целыми числами.
В своих расчетах Дальтон исходил из того, что атомный вес водорода равен 1, и поэтому атомные веса всех элементов в таблице Дальтона представляют собой целые числа. Изучив составленную Дальтоном таблицу атомных весов, английский химик Уильям Праут (1785—1850) пришел в 1815—1816 гг. к мнению, что все элементы в конечном счете состоят из водорода и что атомные веса различных элементов различаются по той причине, что они состоят из разного числа атомов водорода. Эта точка зрения известна как гипотеза Праута .
Однако таблица Берцелиуса, казалось, разрушила это привлекательное предположение (привлекательное потому, что, подобно античным ученым, Праут сводил все возраставшее число элементов к одному основному веществу и, таким образом, как будто бы придавал Вселенной упорядоченность и симметрию). Однако, если принять атомный вес водорода («основы»), равным 1, то атомный вес кислорода составит приблизительно 15.9 веса водорода, но едва ли можно согласиться с тем, что кислород состоит из 15 плюс еще 9/10 атома водорода.
В следующем столетии таблицы атомных весов постоянно уточнялись, и все более очевидными становились выводы Берцелиуса, считавшего, что атомные веса различных элементов не являются целыми числами, кратными атомному весу водорода.
В шестидесятых годах XIX в. бельгийский химик Жан Сервэ Стас (1813—1891) определил атомные веса точнее, чем Берцелиус. В начале XX в. американский химик Теодор Уильям Ричардс (1868—1928), приняв все меры предосторожности (во многом надуманные), определил величины атомных весов с такой точностью, которая только возможна при использовании чисто химических методов. Исследования Стаса и Ричардса ответили на те вопросы, которые в работах Берцелиуса оставались нерешенными.
Нельзя было не принять тот факт, что атомные веса выражаются нецелыми числами, и в свете этого гипотеза Праута, казалась бы, все более теряла смысл. Однако в то время, когда Ричарде проводил свои поразительно точные определения атомных весов, вновь встал вопрос о том, что следует понимать под атомным весом. И на этом этапе развития химии гипотезе Праута, как мы увидим далее, суждено было возродиться. 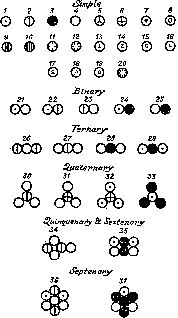
Рис. 9. Символы некоторых элементов и соединений, предложенные Дальтоном; 1 — водород; 3 — углерод; 4 — кислород; 15 — медь; 17 — серебро; 19 — золото; 21 — вода. Дальтон дал неверную формулу воды (НО вместо Н2О), но его формулы монооксида (25 ) и диоксида углерода (28 ) верны.
Поскольку, как выяснилось, атомные веса различных элементов взаимосвязаны не столь простым образом, как это ранее предполагалось, необходимо было выявить стандарт, исходя из которого можно было бы определять атомные веса элементов. Естественным казалось принять за единицу атомного веса атомный вес водорода, как это сделали Берцелиус и Дальтон. Но при этом атомный вес кислорода выражался неудобным нецелым числом 15.9, а ведь именно кислород обычно использовался для определения соотношений элементов в различных соединениях.
Чтобы атомный вес кислорода выражался удобным целым числом при минимальном нарушении стандарта, т. е. атомного веса водорода, атомный вес кислорода округлили и приняли равным 16.000 (вместо 15.9). Таким образом, в качестве стандарта был принят атомный вес кислорода, равный 16; атомный вес водорода при этом оказался равным 1.008. Атомный вес кислорода служил стандартом вплоть до середины XX в.
Смотрите также
Калий и натрий
...
Валентность и степень окисления
В начале 19 века Дж. Дальтоном был
сформулирован закон кратных отношений, из которого следовало, что каждый атом
одного элемента может соединяться с одним, двумя, тремя и т.д. атомами другог ...
