Получение пиразолов реакцией синтеза кольца
Эти гетероциклы можно синтезировать с помощью реакций замыкания цикла и циклоприсоединения. Наиболее общий метод получения пиразолов заключается во взаимодействии 1,3-дикарбонильных соединений или их аналогов (таких, как сложные эфиры енолов) с гидразинами. В качестве примера приведем синтез 3,5-диметилпиразола (13) из пентан-диона-2,4 и гидразина. Недостаток этого метода заключается в том, что несимметричные дикарбонильные соединения или их производные иногда образуют смеси изомерных пиразолов. К хорошим результатам в получении некоторых N-незамещенных пиразолов приводит взаимодействие гидразидов XCSNHNH2 (X=.SR или NR2) с а-галогенокетонами. В ходе реакции в качестве интермедиатов образуются тиадиазины 14, которые либо самопроизвольно, либо при обработке кислотами элиминируют атом серы и превращаются в пиразолы с хорошим выходом.
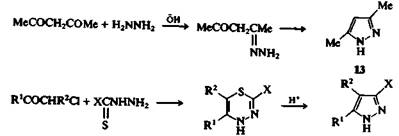
Пиразолы можно также получить циклизацией ацетиленовых гидразинов, электроциклизацией ненасыщенных диазосоединений, 1,3-диполярным циклоприсоединением диазосоединений и нитрилимидов.
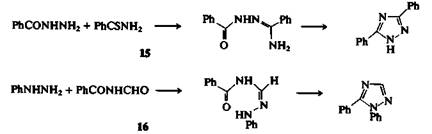
Существует много удобных методов синтеза 1,2,4-триазолов, наиболее важные из которых основаны на создании и циклизации структур типа N—С—N—N—С и С—N—С—N—N. В качестве примера первого типа можно привести термическую конденсацию ацилгидразида с амидом или (что лучше) с тиоамидом (реакция Пеллиццари); так, бензоилгидразид вступает в реакцию с тиобенза-мидом при 140 °С с образованием 3,5-дифенил-1,2,4-триазола (15). Примером второго типа циклизации служит реакция Эйнхорна — Бруннера, в которой гидразин или монозамещенный гидразин конденсируется с диациламином в присутствии слабой кислоты. Так, при взаимодействии фенилгидразина и N-формальбензамида образуется с хорошим выходом 1,5-дифенил-1,2,4-триазол (16).
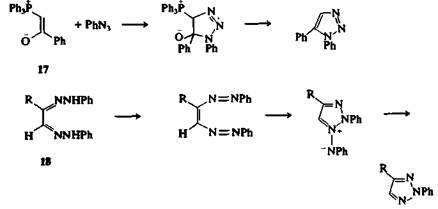
1Н-1,2,3-Триазолы могут быть получены 1,3-диполярным присоединением разнообразных ароматических азидов XN3 (X = алкил, винил, арил, ацил, арилсульфонил и т. д.) к ацетиленам. Некоторые соединения (енолят-анионы, простые эфиры енолов, енамины, а-ацил-фосфорилиды) при взаимодействии с азидами дают 1,2,3-триазолы. Например, илид 17 реагирует с азидобензолом в растворе при температуре 80 °С с образованием 1,5-дифенил-1,2,3-триазола с хорошим выходом. Эти реакции, в противоположность присоединению к ацетиленам, высоко региоселективны. Иногда при присоединении азидов (например, триметилсилил- или ацилазидов) образуются 2Н-1,2,3-триазолы; при этом, очевидно, миграция заместителя к атому N-2 происходит после замыкания цикла. Наиболее часто 2Н-1,2,3-триазолы получают из 1,2-дикетонов. Примером реакции такого типа может служить окислительная циклизация в присутствии солей меди(Н) бис-арилгидразонов 1,2-дикетонов. Возможный механизм циклизации бис-фенилгндразонов а-кетоальдегидов 18 приведен ниже.
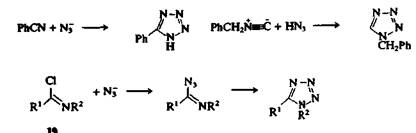
Некоторые распространенные методы получения тетразолов заключаются в присоединении азотистоводородной кислоты (Н3N) или азид-ионов к соединениям, содержащим кратную связь углерод — азот. Примерами таких реакций могут служить:
а) синтез 5-фенилтетразола нагреванием бензонитрила и азида натрия в N,N-диметилформамиде,
б) образование 1-бензилтетразола из бензилизонитрила и азотистоводородной кислоты в присутствии следовых количеств серной кислоты
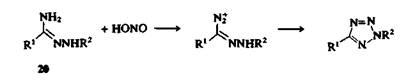
в) превращение имидоил-хлоридов 19 в 1,5-дизамещеиные тетразолы взаимодействием с НЫз или азидом натрия. 2,5-Дизамещенные тетразолы могут быть получены другим способом — реакцией амидразонов 20 с азотистой кислотой.
Смотрите также
Полимеры
...
Аммиак и аминокислоты, их роль в нашей жизни
...
Заключение
Результаты термодинамического расчета показали, что каталитическая
добавка сажи значительно снижает и по сравнению с исходным
составом, снижает содержание в продуктах сгорания конденсированных вещ ...
