Причины обратимости химических процессов.
![]() V
V
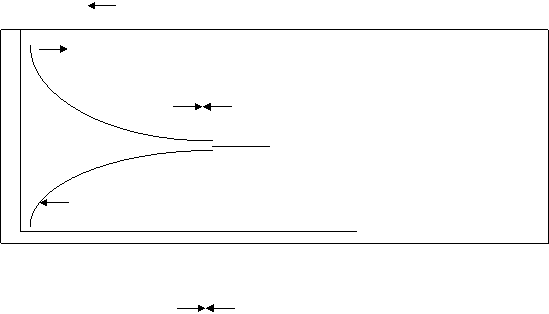 Скорость прямой реакции (V) с течением времени уменьшается, а скорость обратной – увеличивается (V) (Рис.11.1.)
Скорость прямой реакции (V) с течением времени уменьшается, а скорость обратной – увеличивается (V) (Рис.11.1.)
V
V
V=V
равновесие Рис.11.1.
V
время
Запишим кинетические уравнения прямой и обратной реакции.
V=K1[A]a[В]в
V=K2[C]c[D]d
Для состояния равновесия V=V
Приравняем правые части кинетических уравнений
K1[A]a[В]в= K2[C]c[D]d
Берем отношения константы скоростей
K1/K2=[C]c[D]d /[A]a[В]в
Заменим отношение постоянных величин констант скоростей K1/K2 на постоянную величину К, называемую константой равновесия. Получим:
К=[C]c[D]d /[A]a[В]в
Для конкретной равновесной системы
N2(г)+3Н2(г)↔2NH3(г)
выражение константы равновесия будет следующим
К=[NH3]2/[N2][Н2]3
Для равновесных систем закон действующих масс может быть сформулировать так: Химическое равновесие устанавливается, когда произведение концентраций продуктов реакции, возведенных в степени, равные стехиометрическим коэффициентам, деленное на произведение концентраций реагентов, возведенных в соответствующие степени, становится постоянной величиной при определенных условиях.
Константа равновесия является количественной характеристикой химического равновесия. Она не зависит от начальных концентраций реагирующих веществ, но зависит от температуры. Константа равновесия не зависит также и от пути реакции, ее механизма, а определяется только значением равновесных концентраций реагентов и продуктов реакций.
Зная величину константы равновесия и исходные концентрации реагентов можно расчитать равновесные концентрации всех веществ.
Константа равновесия химических реакций связана со стандартным изменением энергии Гиббса этой реакции ΔG0 следующим уравнением.
ΔG0= -2,3RTlgKT
При температуре 250С (Т=298К)
ΔG0298= -5,69lgK298 (кДж/моль)
Смотрите также
Синтез тиоцианомалонового эфира из броммалонового эфира
...
Приложение 6
Подготовка нефти, включая
газовый конденсат, в тоннах
Российская Федераци 910610930
Западная Сибирь 708316453
Тюменская область ...
Химия и медицина
...
