Водородная связь.
![]() F F
F F
H H H H H
F F F
Образованием водородной связи можно объяснить существование очень устойчивого аниона НF2–, состоящего из двух ионов F–, соединенных протоном (F … H – F)–. Аналогичный ион НCl2– мало cтабилен, так как электроотрицательность хлора ЕСl=3 значительно ниже электроотрицательности фтора ЕF =4.
 Благодаря водородной связи, например, муравьиная кислота в газообразной фазе существует в виде димера. O … H–O
Благодаря водородной связи, например, муравьиная кислота в газообразной фазе существует в виде димера. O … H–O
H–C C–H
O–H … O
В жидкой фазе ряд органических кислот (муравьиная, уксусная, хлоруксусная) образуют ассоциаты двух типов: цепи и циклические.
В твердом состоянии все эти кислоты образуют цепные молекулы.
… O
C–CH2Cl
O … HO
ClH2C–C
OH … O
C–CH2Cl
O … HO
ClH2C–C–OH …
Cпособность молекул к ассоциации отличает воду, аммиак, спирт и другие жидкости от неассоциированных жидкостей, например, углеводородов. Ассоциация приводит к повышению температуры плавления, температуры кипения, теплоты парообразования, изменению растворяющей способности и т.д. Если бы вода не образовывала ассоциатов, то имела бы температуру замерзания –100 0С, а температуру кипения –80 0С. (рис.4.35.)
Водородные связи в структуре воды и льда играют важную роль. В кристалле льда (Н2О)n каждая молекула воды тетраэдрически соединена водородными связями с четырьмя ближайшими к ней молекулами. Такую структуру в плоскостном изображении можно представить следующей схемой.
Н
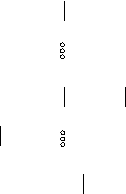 |
Н–О
Н Н
О–Н … О–Н … О–Н
Н Н–О
Н
Это создает ажурную структуру, далекую от плотной упаковки. Поэтому лед имеет небольшую плотность и значительную рыхлость.
![]() При плавлении льда водородные связи частично разрушаются (примерно на 10%). Это несколько сближает молекулы, поэтому вода плотнее льда. Нагревание воды, с одной стороны, приводит к ее расширению, т.е. к увеличению объема, с другой стороны, вызывает дальнейшее разрушение водородных связей и тем самым уменьшает объем. В результате плотность воды проходит через максимум при температуре +4 0С. Считают, что при +4 0С вода содержит ассоциаты из двух молекул (Н2О)2, связанных двумя водородными связями. О … Н Н
При плавлении льда водородные связи частично разрушаются (примерно на 10%). Это несколько сближает молекулы, поэтому вода плотнее льда. Нагревание воды, с одной стороны, приводит к ее расширению, т.е. к увеличению объема, с другой стороны, вызывает дальнейшее разрушение водородных связей и тем самым уменьшает объем. В результате плотность воды проходит через максимум при температуре +4 0С. Считают, что при +4 0С вода содержит ассоциаты из двух молекул (Н2О)2, связанных двумя водородными связями. О … Н Н
Н Н … О
Которые и обуславливают наибольшую плотность воды (равную 1г/см3) при +4 0С. Дальнейшее повышение температуры приводит к расширению воды и к разрыву водородной связи. Молекулы водяного пара почти не ассоциированны.
Водородная связь играет большую роль в процессах растворения. Растворимость веществ во многом зависит от их способности образовывать водородные связи с растворителем.
Водородная связь проявляется почти повсеместно: и в неорганических веществах, и в органических, в белках, в полимерах, в живых организмах. Предполагают, что и действие памяти связано с хранением информации в конфигурациях с Н–связями. Поэтому в последнее время водородная связь стала объектом дополнительного исследования.
Смотрите также
Творческая работа по химии: кислород
...
Химия кадмия
...
Синтез гексагидроксоплатината калия
Платина и ее соединения широко используются в качестве
катализаторов во многих химических и электрохимических процессах, в частности,
в процессах окисления метанола и СО. Учитывая высокую ст ...
