Термодинамика смесей идеальных газов. Характеристические функции идеального газа.
Для адиабатического процесса в системе (Q = 0) мы можем записать ΔU= -A.
Если идеальный газ расширяется адиабатически от объема V и температуры T до бесконечно большого объема, то он совершает работу:
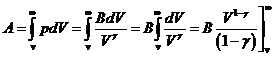 ,
,
а поскольку ![]() , то подстановка верхнего предела дает 0, подстановка нижнего приводит к
, то подстановка верхнего предела дает 0, подстановка нижнего приводит к 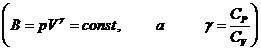 ,
,
![]() .
.
Следовательно ![]() , а поскольку
, а поскольку ![]() , то внутренняя энергия идеального газа, имеющего данную температуру, равна U = CVT.
, то внутренняя энергия идеального газа, имеющего данную температуру, равна U = CVT.
Очевидно, поскольку для идеального газа dU = CV dT, то по первому закону для идеального газа: dQ = CVdT + pdV.
Разделив правую и левую часть на Т, получим ![]() .
.
Интегрирование дает ![]()
![]() .
.
Константа интегрирования S0 не зависит ни от температуры, ни от давления или объема. Как мы увидим позднее для любого вещества в состоянии идеального газа в константу S0 в качестве характеристики вещества входит только его мольная масса. Далее:
H = U + pV = U + RT = CVT +RT = CpT,
F = U – TS = CVT – TS0 - CVT ln T –RT ln V,
G = H – TS = CpT – T( S0 + R ln R ) – CpT ln T + RT ln p,
Легко видеть, что, вообще говоря,
F = F (T) – RT ln V, G = G (T ) + RT ln p,
где F (T) и G (T) - являются функциями только температуры.
Смотрите также
Алкилирующие агенты
Алкилирующие
агенты - весьма ценные реагенты в органическом синтезе. Алкилированием
называется процесс введения алкильной группы (радикала) в молекулу вместо атома
водорода:
алкилир.аген ...
Пасты, эмульсии. Пены, суспензии
...
Методики теоретического и экспериментального исследования
системы Al - АГСВ - каталитические
добавки
В данной главе
описаны основные методики, которые использовались в данной работе. А именно:
– методика
термодинамического расчета по программе Астра-4;
– методика
зажигания нагретой ...
