Постулат Планка. Абсолютная энтропия.
Зададимся вопросом, каково изменение энтропии некоего процесса, который протекает при температуре около абсолютного нуля. Например, имеем две кристаллические модификации металлического олова: низкотемпературную, α - Sn, и высокотемпературную – обычное белое олово, β – Sn. Они находятся в равновесии при 14 0С (287 К), теплота равновесного превращения 497 кал/моль, а энтропия его ![]()
Легко сообразить, чтобы дать ответ на поставленный вопрос, необходимо взять β – Sn при 0 К, нагреть до температуры 14 0С, равновесно превратить β – Sn в α – Sn, и затем охладить α – Sn до абсолютного нуля, тогда суммарное изменение энтропии будет:
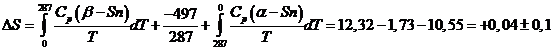 ,
,
т.е. изменение энтропии в пределах ошибок опыта равно нулю, а отсюда следует, что энтропии α – Sn и β – Sn одинаковы.
Исходя из многочисленных подобных экспериментов (мы их обсудим позднее в гл.16), Планквыдвинул постулат: энтропия идеального кристаллического тела при абсолютном нуле равна нулю.
Абсолютные энтропии веществ, измеренные экспериментально или вычисленные теоретически, приводятся в справочниках термодинамических величин (где и теплоты образования).
