Изменение энтропии в различных процессах.
![]() , причем знак = относится к обратимым процессам, а знак > к необратимым.
, причем знак = относится к обратимым процессам, а знак > к необратимым.
Если требуется вычислить энтропию необратимого процесса необходимо провести обратимый процесс между теми же самыми конечным и начальным состоянием (используем тот факт, что энтропия – функция состояния).
а) Изотермический процесс:
![]() , Q – часто это скрытая теплота фазовых переходов.
, Q – часто это скрытая теплота фазовых переходов.
б) Изменение температуры при ![]()
![]() :
:
![]()
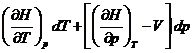 , следовательно
, следовательно 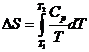 , т.к.
, т.к. ![]()
Энтропия необратимого процесса: ![]()
Теплота конденсации при 298 К равна – 10519 кал, ![]()
Ответ, очевидно, неверен, поскольку процесс необратимый. Проведем его обратимо: ![]()
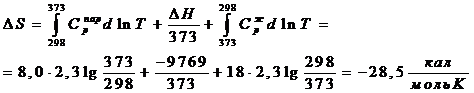
(-9769 – теплота конденсации при 373 К)
![]()
Заметим, что действительно ![]() меньше, чем
меньше, чем ![]() .
.
4.5. Закон Джоуля
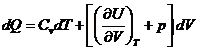 ,
,
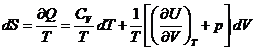 – это полный дифференциал, следовательно
– это полный дифференциал, следовательно 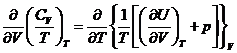 .
.
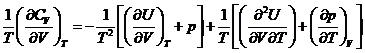 ,
, ![]()
![]()
![]() .
.
Для идеального газа ![]()
![]() и
и ![]() ,
,
Для любых систем ![]() ,
,
Для газа Ван-дер-Ваальса ![]() и
и ![]() .
.
Смотрите также
Хром
К металлам побочных подгрупп периодической системы Д. И. Менделеева
относятся все d-элементы. Таких
подгрупп 10: скандия, титана, ванадия, хрома, марганца ...
Выбор и обоснование схемы
автоматизации производственного процесса
Автоматизированные системы
управления – это человекомашинные системы, обеспечивающие автоматический сбор,
обработку информации и оптимизацию управления.
АСУТП предназначены для
выработки и реали ...
Методы разделения иммуноглобулинов
Иммуноглобулины - основные защитные белки
организма, так как они обладают свойствами различных антител. Они содержатся
в крови, молозиве и молоке, слюне и других жидкостях. С их количест ...
