Кислотно-каталитические процессы в нефтепереработке и в нефтехимии. Каталитический крекинг
Каталитическим крекингом называют совокупность различных превращений углеводородов, протекающих на кислотных катализаторах (в настоящее время – гетерогенных) с образованием компонентов авиационного и моторного (автомобильного) топлива из высококипящих фракций углеводородов.
Основные реакции:
(1) Деалкилирование (крекинг) парафинов
![]()
(2) Деалкилирование (крекинг) олефинов
![]() (n = m + k)
(n = m + k)
(3) Деалкилирование алкилароматических соединений
![]()
(4) Ароматизация нафтенов
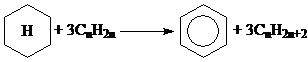
(5) Скелетная и позиционная изомеризация олефинов.
(6) Скелетная изомеризация парафинов
В современных процессах используют аморфные и кристаллические (цеолиты) алюмосиликаты Al2O3 – SiO2. Цеолиты бывают природные и синтетические. Общая формула цеолита
MxDy/2 AlmSinO2(m+n)·PH2O, x + y = m
где M и D – одно- и двухвалентные катионы. В настоящее время только X- и Y- синтетические цеолиты используются для крекинга углеводородов. Эти цеолиты близки природным цеолитам – мордениту (X) и шабазиту (Y). При общей формуле этих цеолитов
NapAlpSi192–pO384·gH2O
для X-цеолита P = 96 – 74, для Y-цеолита P = 74 – 48.
Кристаллическая структура цеолитов характеризуется сквозными порами одинакового диаметра (0.75 – 1.0 нм), превышающими размеры многих молекул углеводородов. При замене части ионов Na+ на ионы NH4+ и последующей прокалки на поверхности цеолита образуются сильные протонные центры
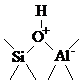
При отщеплении воды ( > 400оС) появляются апротонные кислотные центры Льюиса, локализованные на Al. Высококремнистые и термостабильные цеолиты ZSM-5 относят к очень сильным протонным кислотам (к сверхкислотам).
В основе теории механизмов реакций, протекающих в процессе каталитического крекинга, лежат представления об участии в стадиях механизмов ионов карбения и карбония и, таким образом, химия этих ионов и есть суть механизмов перечисленных выше процессов.
CH3+, R+ CH5+, RH2+
ионы карбения ионы карбония
На поверхности твердых кислотных катализаторов так же, как и в растворах, нет свободных ионов карбения R+. Такие частицы всегда сольватированы в растворах и переносятся на другие реагенты, освобождаясь от молекулы растворителя (как и H+).
![]()
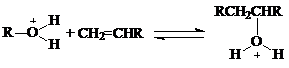
На поверхности кислотных катализаторов можно представить аналогичный процесс “сольватации” (координации) иона карбения поверхностным оксидом
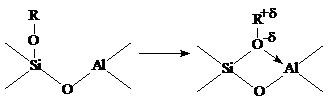
Координированный таким образом R+ аналогичен иону карбения в ионе алкоксония R3O+BF4– и может участвовать в реакциях с другими реагентами (олефинами, спиртами, аренами) аналогично реакциям алкоксониевых ионов в реакции полимеризации циклов (см. раздел 11). Ионы карбония могут находится в свободном состоянии, удерживаясь на поверхности за счет слабых водородных связей или за счет электростатических сил в виде ионных пар RH2+·X–.
В целом механизм процессов крекинга парафинов, олефинов, скелетной изомеризации парафинов и олефинов, реакций деалкилирования алкиларенов является цепным с кинетической точки зрения. Все эти процессы включают стадии инициирования, зарождения активных центров R+ (Wi), стадии продолжения кинетической цепи с участием ионов карбения и карбония и стадии обрыва активных R+ (W0) за счет примесей в реакционной смеси. Добавки долей процента олефинов к чистому алкану резко ускоряют процесс каталитического крекинга.
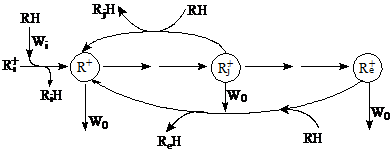
Образование кокса на поверхности алюмосиликатных катализаторов (следствие глубокого дегидрирования полимеров) является основной причиной дезактивации катализаторов крекинга, наряду с обратимым отравлением сильно адсорбирующимися примесями и необратимым отравлением металлами, содержащимися в нефтяных фракциях.
Различные функции падения активности по времени обобщены в теории, учитывающей, как важный фактор, время проведения процесса и предполагающей параллельное протекание различных процессов, ведущих к отравлению катализатора, т.е. к уменьшению количества активных центров CS. Уравнение (1) не включает концентраций реагентов и ядов и является, таким образом, эмпирическим уравнением, но оно было успешно применено для большого числа реакций крекинга и дегидрирования
![]() (1)
(1)
Если обозначить долю центров, сохранивших активность, Q = CS/CS0, получим
