Строение молекулы
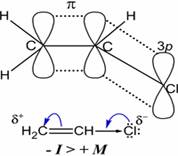
Условная молекулярная структура винилхлорида. В молекуле винилхлорида связь C—Clболее короткая и более прочная, чем аналогичная связь в молекуле хлорэтана, что связано с p—π
сопряжением π-орбиталей кратной связи с неподеленной электронной парой атома хлора. В таблице представлены сравнительные значения длин и энергии связей, а также дипольных моментов в молекуле винилхлорида и некоторых хлоралканов:
|
Соединение |
Энергия связи C-Cl, кДж/моль[13] |
Длина связи C-Cl, нм[12] |
Дипольный момент, 10-30 Кл*м[4] |
|
CH2=CHCl |
374,89 |
0,169 |
4,80 |
|
CH3-CH2Cl |
336,39 |
0,179 |
6,66 |
|
CH3Cl |
349,78 |
0,176 |
6,19 |
Смещение электронной плотности в молекуле винилхлорида от атома хлора в сторону двойной связи, благодаря эффекту сопряжения ( + M эффект)
, действует одновременно с сильным электроноакцепторным индуктивным эффектом атома хлора ( − I эффект)
, однако влияние последнего сильнее ( − I > + M )
, поэтому галоген несёт на себе небольшой отрицательный заряд (см. рисунок)http://ru.wikipedia.org/wiki/%D0%A5%D0%BB%D0%BE%D1%80%D0%B2%D0%B8%D0%BD%D0%B8%D0%BB - cite_note-neyland-13#cite_note-neyland-13.
Смотрите также
Синтез 1,3,5-трийодбензола
...
Приложение 7
Статестические
данные добычи нефти и кол-во нефтяных скважин.
Год
...
Полистирол
...
