Развитие истории химии.
В таком определении ВАЛЕНТНОСТЬ, естественно, всегда выражается целыми числами. Поскольку в то время для водорода не были известны соединения, где он был бы связан более чем с одним атомом любого другого элемента, атом Н был выбран в качестве стандарта, обладающего ВАЛЕНТНОСТЬЮ, равной 1. В "водородной" шкале кислород и сера имеют ВАЛЕНТНОСТЬ, равную 2, азот и фосфор 3, углерод и кремний 4. Однако "водородной" шкалы оказалось недостаточно: в других соединениях, например в окислах, один и тот же элемент может реализовать ВАЛЕНТНОСТЬ, которые не осуществляются в гидридах (существуют окислы P2O5, SO3 и Cl2O7, но неизвестны гидриды PH5, SH6 и ClH7). В качестве второго стандарта с ВАЛЕНТНОСТЬЮ, равной 2, был выбран кислород.
В конце 50-х гг. 19 А. С. Купер и А. Кекуле постулировали принцип постоянной четырёхвалентности углерода в органических соединениях. Представления о ВАЛЕНТНОСТИ составили важную часть теории химического строения А. М. Бутлерова (1861) Образование химической связи рассматривалось как результат взаимного насыщения двух пар взаимодействующих атомов (по одной ВАЛЕНТНОСТИ от каждого), кратные связи соответствовали насыщению нескольких ВАЛЕНТНОСТЕЙ от каждого атома, и т.д. Каждая связь считалась локализованной между двумя атомами и изображалась одной чертой, соединяющей эти атомы. Молекулы стали изображать с помощью структурных формул, получивших особенно широкое распространение в органической химии.
Положения Бутлерова в дальнейшем легли в основу структурной теории, рассматривающей и пространственное расположение атомов в молекуле. Было найдено, что простые молекулы типа MXk с одинаковым центральным атомом M и разными заместителями Х имеют схожее геометрическое строение. Независимость геометрического строения от типа связи в широких пределах привела к мысли, что пространственное расположение атомов в молекулах MXk определяется ВАЛЕНТНОСТЬЮ центрального атома М и что эти ВАЛЕНТНОСТИ имеют направленный характер.
Периодический закон Д. И. Менделеева (1869) вскрыл зависимость ВАЛЕНТНОСТИ элемента от его положения в периодической системе. Элементы одинаковых групп системы обладают одинаковой высшей ВАЛЕНТНОСТЬЮ, в большинстве случаев равной номеру той группы, в которой находится этот элемент; высшая ВАЛЕНТНОСТЬ меняется на 1 при переходе от одной группы к соседним.
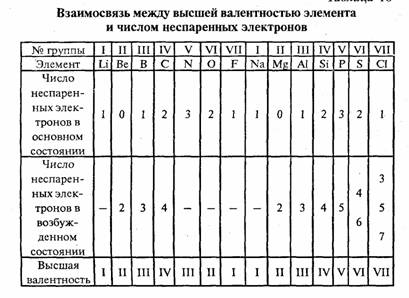
Эта зависимость сыграла чрезвычайно важную роль в развитии химии: зная лишь положение элемента (в том числе элементов, которые в то время ещё не были открыты) в периодической системе, можно было определить его валентные возможности, предсказать состав его соединений и впоследствии синтезировать их. С помощью представлений о формальной (стехиометрической) ВАЛЕНТНОСТИ химикам удалось обобщить и систематизировать огромный экспериментальный материал по строению, стехиометрическому составу и свойствам многих десятков и сотен тысяч органических и неорганических соединений.
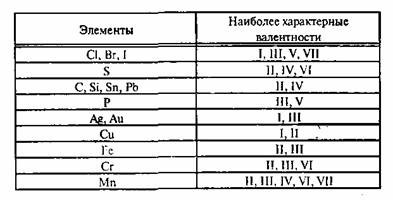
В таблице приведены некоторые примеры веществ с характерными для них валентностями:
Смотрите также
Выводы по проекту
Эффективный фонд времени работы оборудования составил
8426,4 ч./год.
Капитальные затраты на здания и оборудование составляют 81931,5 тыс. руб.
Средняя годовая заработная плата одного основного
...
Элементы статистической термодинамики
...
Химия и Стоматология
Зубоврачевание является одним из древнейших разделов
медицины. Как показывают результаты исследований костей раннего периода,
заболевания кариесом и парадонтитом встречались во все времена, ...
