2. Закон Гесса
При изобарных и изохорных условиях теплота является функцией состояния.
В 1840 г. Г. Н. Гесс
формулирует закон: «Тепловой эффект химической реакции не зависит от промежуточных стадий, а зависит только от начального и конечного состояния системы».
δQP = dH,
δQV = dUвн,
QP = ΔH,
QV = ΔUвн.
Современная формулировка закона Гесса
– общие приращения энтальпии при переходе начальных веществ в продукты реакции не зависят от того, через какие промежуточные стадии прошла реакция.
Закон Гесса позволяет рассчитать тепловые эффекты или приращение энтальпии только при стандартных условиях (р = 1 атм = 105 Па, Т = 273 К + 25 = 298 К).
Теплоты при стандартных условиях сведены в таблицу (справочник под редакцией Нищенко). Для индивидуальных веществ: С, Н2, Fe и др. – ΔН = 0.
Следствия из закона Гесса:
1) энтальпия образования 1 моля соединения из простых веществ не зависит от способа получения;
2) теплоты сгорания – «теплота реакции равна сумме теплот сгорания исходящих веществ за вычетом теплот сгорания продуктов реакции с учетом стехиометрических коэффициентов» 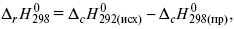
где r – реакции;
c – композиция;
3) теплоты образования – «тепловой эффект реакции равен разности между теплотами образования всех веществ, указанных в правой части уравнения (продукт реакции), и теплотами образования всех веществ, указанных в левой части уравнения». 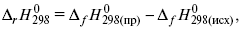
где f – формация.
Пример 1.
Рассчитать тепловой эффект реакции этерификации спирта. 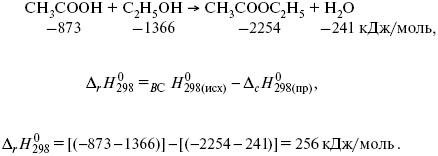
Пример 2.
Рассчитать тепловой эффект реакции, протекающей по уравнению: 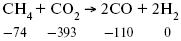
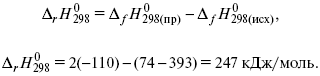
Смотрите также
Материальный баланс
Схему переработки можно разбить на 5 блоков:
Дробление и измельчение.
Грануляция и окисление в печи кипящего слоя.
Выщелачивание и фильтрация.
Осаждение и фильтрация.
Прокалка и су ...
Список
сокращений
1.
БЕ
– буферная емкость.
2.
БР
– блок подготовки и закачки реагента.
3.
БРХ
– блок реагентного хозяйства.
...
