1. Суть физико-химического анализа
Задача физико-химического анализа состоит в установлении зависимости свойств равновесной системы от параметров состояния. Под параметрами состояния обычно понимают: состав, давление, температуру. Зависимости выражаются в виде различных диаграмм «параметр состояния – свойство». На практике большое значение имеет диаграмма «состав – свойство». Анализ именно такой диаграммы позволяет получать сведения о характере взаимодействия компонентов, о давлении и концентрации компонентов, о составе и устойчивости образующихся в системе химических соединений. Совокупность зависимостей всех свойств равновесной системы от параметров состояния позволяет изобразить в виде графика фазовую диаграмму – диаграмму состояния. Чтобы рассмотреть каждую диаграмму состояния систем, пользуются понятиями: фаза, система, степень свободы, компонент, составляющее вещество, термодинамическое равновесие. Раскроем суть этих понятий.
Компонент
– химически индивидуальные вещества, наименьшего числа которых достаточно для образования всех фаз, т. е. гомогенных частей данной системы.
Система
– совокупность тел, находящихся во взаимодействии между собой и отделенных от окружающей среды. Различают физическую и химическую системы. Если составные части системы не вступают друг с другом в химические реакции, то такая система называется физической
. Если составные части системы реагируют друг с другом, то она называется химической.
Составляющее вещество
– вещество, которое может быть выделено из системы и существовать вне ее.
Степень свободы (вариантность)
– число независимых параметров системы, которые можно произвольно менять в некотором интервале без изменения вида и числа фаз системы.
Термодинамическое равновесие
– состояние, к которому самопроизвольно стремится система. Она находится в состоянии термодинамического равновесия в том случае, когда изменение свободной энергии Гиббса равно нулю.
Фаза
– гомогенная часть гетерогенной системы, ограниченная поверхностью раздела от других частей.
Раскрыв суть важнейших понятий физико-химического анализа, рассмотрим правила и принципы, лежащие в его основе.
Правило фаз
– число степеней свободы равновесной системы, на которую из внешних факторов влияют только давление и температура, равно числу независимых компонентов системы плюс два минус число фаз, т. е.
F = k + 2 – z ,
где F – число степеней свободы;
k – число компонентов;
z – число фаз;
число 2 – два независимых параметра системы: давление и температура.
Применим правило фаз к однокомпонентной системе:
F = 1 + 2 – z .
Итак, в этой системе максимальное число фаз, одновременно находящихся в равновесии, равно трем. Состояние равновесия однокомпонентной системы определяется ее объемом, температурой, давлением:
f (P , T , V ) = 0.
Рассмотрим возможные состояния однокомпонентной системы, сведенные в таблицу 5.
Таблица 5
Фазовые состояния однокомпонентной системы
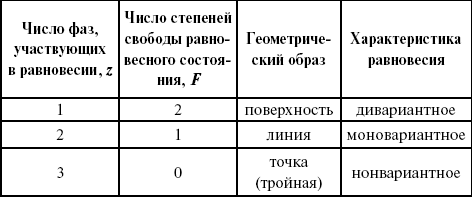
Рассмотрим зависимость между числом фаз и числом степеней свободы в двухкомпонентной системе.
Смотрите также
Экономическое обоснование проекта
Расчет капитальных затрат на
создание проектируемого объекта
Таблица №28 - Расчет
капитальных затрат на здания и сооружения
Наименования
зданий и сооружений
Ед. изм.
...
Синтез ацетилферроцена
Ферроцен
(дициклопентадиенилжелезо) - металлорганическое соединение железа с пентагональной
антипризматической «сэндвичевой» структурой. Благодаря своему
высокосимметричному сэндвичевому ст ...
