5. Расчет равновесного состава химического равновесия
Равновесный состав можно рассчитать только для газовой системы 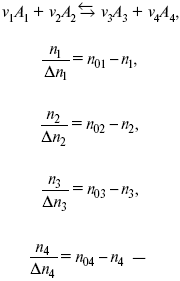
равновесная концентрация.
Исходная концентрация всех компонентов 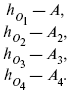
Изменение каждого компонента по числу молей (или стехиометрическому коэффициенту): 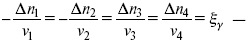
ξγ – (пробег реакции) – химическая переменная.
Она показывает изменение количества вещества по числу молей. Если реакция не началась, то ξγ = 0. Если количество исходных веществ превратилось в такое же количество продуктов реакции, то ξγ = 1.
3H2 + N2 = 2NH3; ξγ= 1,
1,5H2 + 0,5N2 = NH3; ξγ= 0,5,
v 1А 1 + v 2А 2 = v 3А 3+ v 4А 4, – газовая реакция.
Рассчитать равновесный состав по третьему компоненту при условии, что А = а моль/л; В = в моль/л. 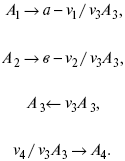
Рассчитываем по 4 компоненту: 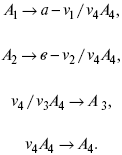
Задача.
Газообразные вещества реагируют по уравнению: 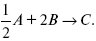
Общее давление в газовой смеси – Р общ, общий объем – V об. Рассчитать KP и Kс.
Найти парциальное давление каждого компонента.
Вещества А и В превращаются в С в количестве Х. Исходные вещества А= 2 моль, В= 1 моль.
Для того, чтобы найти парциальное давление, мы должны Р об умножить на мольную долю. Мольная доля определяется отношением числа молей каждого компонента, отнесенного к общему числу молей всех компонентов. 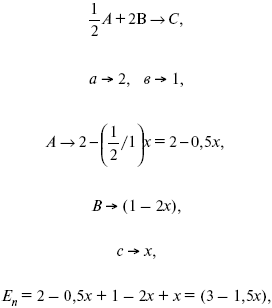
где En – общее число молей, участвующих в этой газовой смеси. 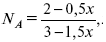
где NA – мольная доля А. 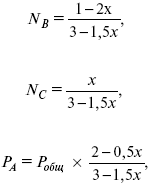
где РА – парциальное давление. 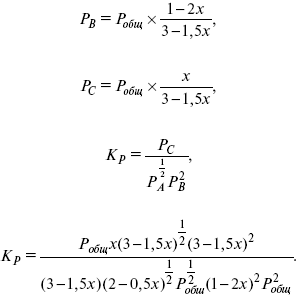
Расчет Kc:
Δv = l – 0,5 – 2 = – 1,5,
где Δv – изменение количества молей. 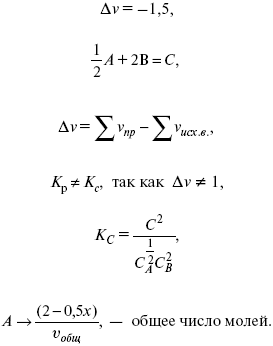
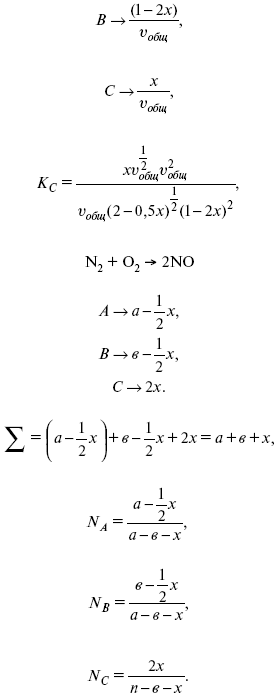
Смотрите также
Амилолитические препараты
Амилолитические препараты широко выпускаются в нашей стране
и за рубежом. В основном это крупнотоннажное производство. Амилазы находят
применение почти во всех областях, где перерабатываетс ...
Принципиальная схема проведения АЭСА
В основе спектрального
анализа лежит изучение строения света, который излучается или поглощается
анализируемым веществом. Рассмотрим схему эмиссионного спектрального анализа
(рис. 1). Для того чтоб ...
Биография и научная деятельность Юстуса Либиха
(1803-1873)
...
