2. Уравнение изотермы химической реакции
Если реакция протекает обратимо, то ΔG = 0.
Если реакция протекает необратимо, то ΔG ≤ 0 и можно рассчитать изменение ΔG. 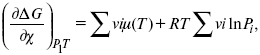
где χ – пробег реакции – величина, которая показывает, сколько молей изменилось в ходе реакции. I сп – характеризует равновесное и неравновесное состояние реакции, II сп – характеризует только неравновесные состояния.
Если
д χ = 1,
то 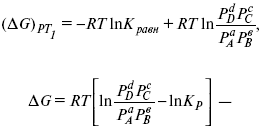
это уравнение изотермы химической реакции
. 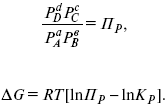
С помощью уравнения изотермы химической реакции можно судить о направлении протекания реакции.
1) Пp< Кp, ΔG < 0, слева направо;
2) Пp> Кp, ΔG > 0, справа налево;
3) Пp= Кp, ΔG = 0, химическое равновесие.
Смотрите также
Золото и его переработка
Основные свойства Начинать разговор о золоте лучше всего со свойств
этого металла и только потом переходить к тому, как эти свойства используются
человеком. Золото интересно тем, что в его х ...
Каучуки
Каучуки — натуральные или
синтетические материалы, характеризующиеся эластичностью, водонепроницаемостью
и электроизоляционными свойствами, из которых путём специальной обработки
получают р ...
Алхимия как культурный феномен арабского и европейского средневековья
Алхимия осталась
феноменом Средневековья, тупиковой ветвью познания. Её долго обвиняли в том,
что она – лженаука, но во многом благодаря ей появилась истинная наука – химия.
В алхимиках же ...
